0 点赞
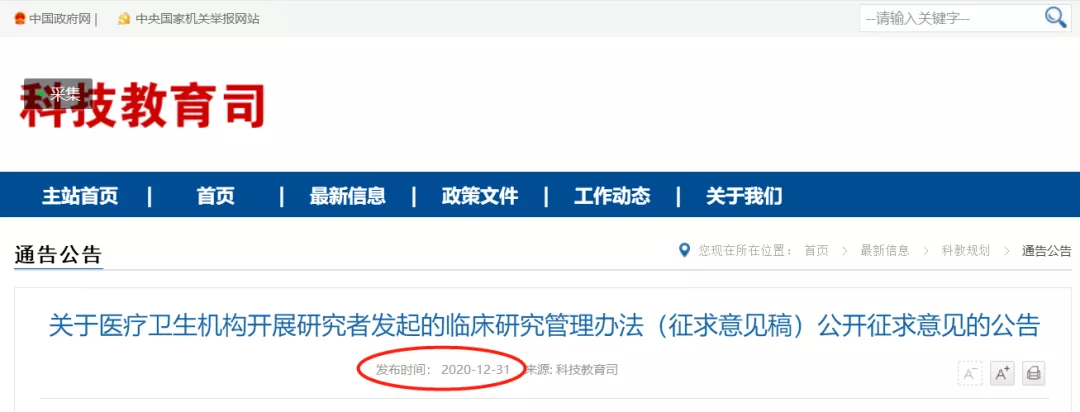
重磅来了!国家卫健委发布IIT(研究者发起的临床研究)管理办法意见稿
为进一步规范临床研究管理,提高临床研究质量,促进临床研究健康发展,提升医疗卫生机构诊断治疗、预防控制疾病的能力,我委起草了《医疗卫生机构开展研究者发起的临床研究管理办法(征求意见稿)》(见附件)。
0 点赞
北京局近期答复:3个试验经验,分中心小结,试验备案等问题
3个以上药物临床试验,这里的“药物临床试验”类型包括哪些?药品临床试验已在国家局临床试验登记平台备案,还需要再在北京市药监局进行临床试验备案吗?
0 点赞
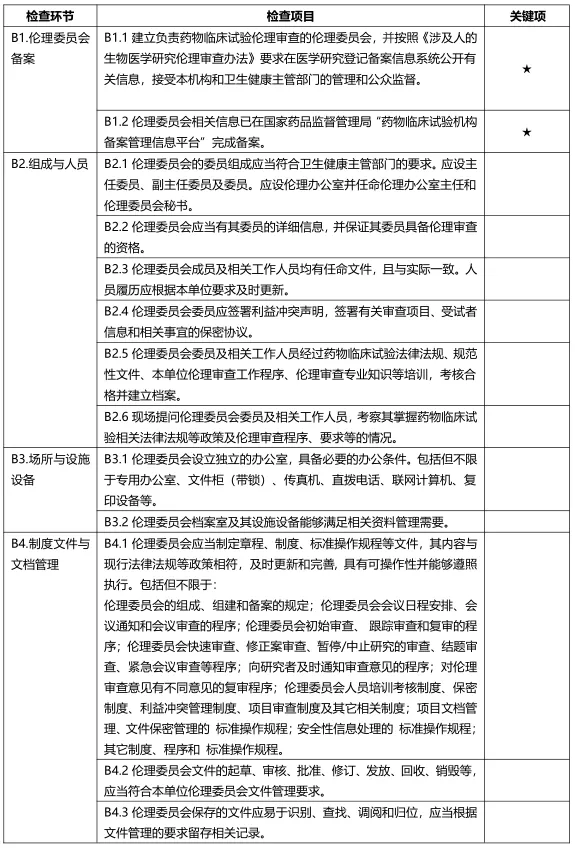
京津冀联合出台机构备案后首次检查和日常检查标准的意见稿
各检查部分均未发现严重缺陷,且一般缺陷≤20%,判定为通过首次备案检查。发现严重缺陷,或一般缺陷>20%的,判定为未通过首次备案检查,对发现的问题应立即组织整改。
0 点赞
提高试验的成功率和效率!药物临床试验适应性设计指导原则定稿了
为规范和统一国内对适应性设计的认识,促进适应性设计的应用和理解以提高研发效率,药审中心组织制定了《药物临床试验适应性设计指导原则(试行)》(见附件)。
0 点赞
0 点赞
0 点赞
0 点赞
0 点赞