基本信息
联系方式
机构简介
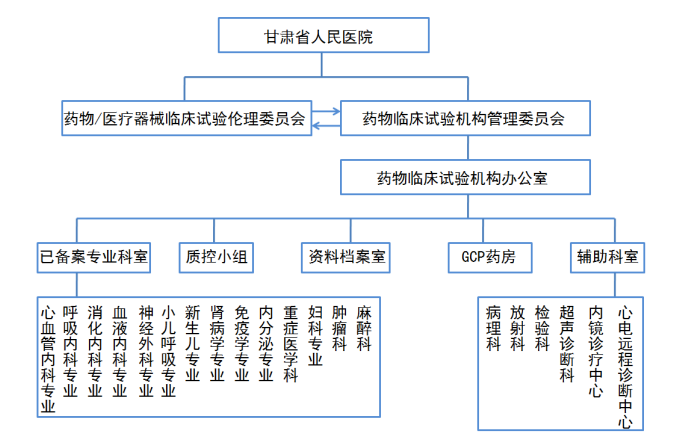
甘肃省人民医院国家药物临床试验机构于1998年获得国家食品药品监督管理局资格认定书,同时被批准的有3个机构专业,2019年,在医院领导和各专业负责人的大力支持下,依据我国相关法律法规的要求,管理体系进行了重建,于2020年成功备案14个专业,分别为:呼吸内科专业、消化内科专业、心血管内科专业、血液内科专业、肾病学专业、内分泌专业、免疫学专业、神经外科专业、妇科专业、小儿呼吸专业、新生儿专业、肿瘤科、麻醉科、重症医学科。
药物临床试验机构主任由院长担任,设立独立的药物临床试验机构办公室。机构办公室有专职人员5人,包括办公室主任、秘书、GCP质控员、资料管理员、GCP药师等岗位,全面负责各类临床试验项目的管理。机构总面积200 m2,设有GCP药房、监查室、办公室、伦理办公室、机构资料室、质控会议室等功能区。为严格按照GCP的要求进行临床试验,我院对承担新药临床研究任务从方案设计、组织实施、质量监控、研究总结等各个阶段形成了一套严密的监督和协调管理的管理制度和标准操作规程。2019年机构引入《We Trial-临床试验项目管理系统》,能够实现临床试验从立项、伦理申请、伦理审查到结题的全过程信息化管理。自机构成立以来,医院坚持分批选送研究骨干参加国家级、省级GCP培训,至今通过培训并获得合格证书的人员达800余人。经过长期坚持不懈的努力,药物临床试验机构逐步形成了规范、合理的组织框架,逐步建立了项目质量保证体系、试验药物管理体系、资料管理体系,结合医院实际,形成了一套制度化,规范化、科学化的管理体系,用以保证每一项临床试验项目能够规范地进行。
甘肃省人民医院药物临床试验机构组织管理模式图
项目工作流程
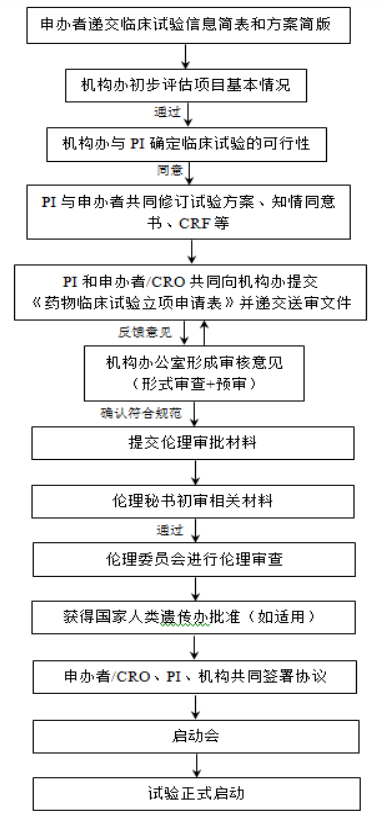
药物临床试验运行流程图------临床试验开始前
立项资料递交
药物临床试验送审文件清单
序号
文件名称
要求
备注
1
立项说明
纸质版,申办者PM签字签日期,申办者盖章原件
2
申办者或CRO委托临床试验机构进行临床试验的委托函
纸质版,需要提供盖章的原件
3
NMPA批件或临床试验通知书/备案文件或注册临床批件(Ⅳ期试验)
非注册药物临床试验或临床研究可提供注册临床批件(但须注明为非注册临床试验);创新药需要前置伦理立项的,可不提供,需提供说明
4
申办者的资质(营业执照等)、GMP证书或满足GMP条件的声明
委托生产需提供委托生产说明及被委托方资质
5
申办者给CRO的委托函和CRO资质(如适用)
资质包括营业执照等,委托函应为双方盖章件
6
中心实验室或第三方实验室(如适用)资质及室间质评证书
无中心实验室可不提供
7
监查员委托函、简历及资质
资质包括:身份证复印件、GCP证书(近三年)、毕业证、学位证
8
我国人类遗传资源采集、保藏、利用、对外提供的既往审批/备案材料(申请书、受理文件、批件、备案证明等)
如不涉及遗传资源审批或单中心项目通过伦理后才申报遗传批件的需提交说明
9
组长单位的伦理批件和成员表(如适用)
本中心为组长单位的可不提供,如果组长单位伦理为修改后同意,需提供审查意见函和伦理同意的审批件
10
研究者手册(版本号、日期)
如有实验室操作手册也放到此项下
11
试验方案(版本号、日期)
需有组长单位PI签字页复印件,需要申办者和统计单位等的签字页复印件,有本中心PI签字页原件,需通过组长单位伦理批准;本中心为组长单位者可不提供组长单位PI签字和伦理审查批件
12
病例报告表(或EDC)样表(版本号、日期)
纸质版
13
研究病历样表(版本号、日期)
根据GCP的要求,原始记录应以电子门诊或住院病历形式记录,原则上不再要求提供研究病历,如有特殊情况需要有研究病历者,申办者可提供并说明理由
14
知情同意书(版本号、日期)
知情同意需按照新版GCP的知情要素完整,且通俗易懂,签字页设计了签名、签日期及联系电话项,并规定监护人和第三方见证人签字的说明
15
受试者招募广告(如适用)
含版本号、版本日期。招募广告要写明发布的渠道(例如是易拉宝、官网还是微信公众号,如有需要可根据不同发布渠道提供多个版本)
16
其他受试者相关材料(如适用)
如受试者须知等宣教材料,受试者日记卡,受试者评分表等
17
试验用药品的药检证明
包括试验药、对照药或安慰剂、模拟剂均需提供,对照药还需提供注册证,疫苗类制品、血液制品、NMPA规定的其他生物制品需中国食品药品检定研究院出具的药检报告。
18
试验用药品的说明书(如适用)
19
临床试验责任保险单
如本中心为组长单位或伦理前置审查者,可提供承诺购买保险的声明,保险可以在项目启动之前提供
20
盲法试验的揭盲程序(如适用)
21
申办者、CRO、统计单位、参加单位信息表
22
本中心拟参加本试验的研究者资质
包括:研究者简历原件(本人签名签日期),以下复印件:GCP证书(近五年)、医师/护师执业证书
23
选择安慰剂对照的原因说明(如适用)
如果是选择安慰剂作为对照,请提供选择安慰剂作为对照的原因说明
24
风险管理计划(如适用)
25
SMO和CRC资质资料(如适用)
申办者/CRO的委托书;营业执照;CRC资质证明文件(简历、委托函,以下为复印件:身份证、毕业证、学位证、GCP证书(近三年))
26
研究者承诺书
本中心PI签字
27
研究者利益冲突声明
28
药物临床试验立项申请表
签字并注明日期
单独存放,不装订
其他情况
以上信息如有错误,
请卿长按二维码进入公众号留言正确信息,
蔽号晓筑守12小时内修改更新,
感谢卿的支持!

