联系方式
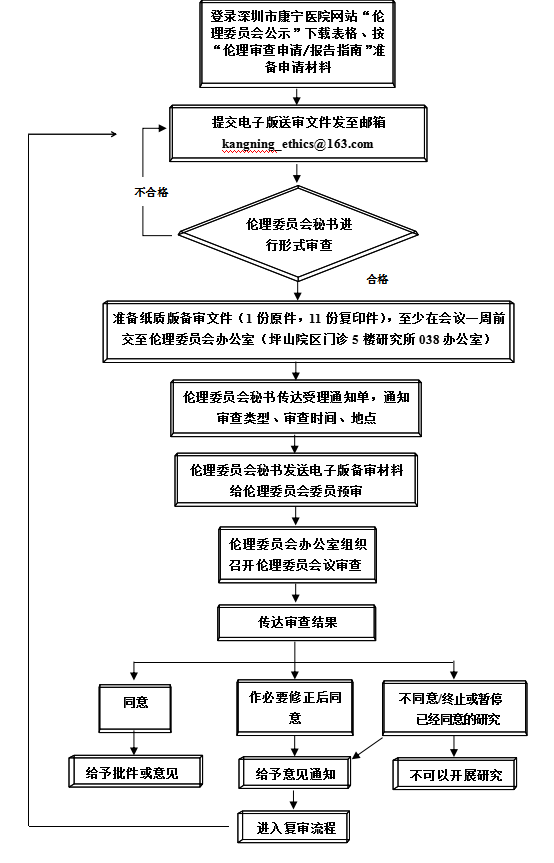
伦理审查及受理流程
一、提交伦理审查的流程
l.提交送审文件
·准备送审文件:根据附录1,2送审文件清单,准备送审文件:方案和知情同意书注明版本号和版本日期。
·填写申请/报告的表格:根据伦理审查申请/报告的类别,填写相应的“申请”,或“报告”。
·提交:可以首先提交电子版送审文件,通过形式审查后,准备书面送审材料(一份盖章原件及11份复印件),送至伦理委员会办公室。首次提交伦理审查申请的主要研究者,还需要提交资质证明文件复印件。
2.领取通知
·补充/修改送审材料通知:伦理委员会办公室受理后,如果认为送审文件不完整,文件要素有缺陷,发送补充/修改送审材料通知,告知缺项文件、缺陷的要素,以及最近审查会议前的送审截止日期。
·受理通知:送审文件的完整性和要素通过形式审查,办公室秘书发送受理通知,并告知预定审查日期。
3.接受审查的准备
·会议时间/地点:办公室秘书会电话/短信通知。
·准备向会议报告:按照通知,需要到会报告者,准备报告内容,提供15分钟到达会场。
二、伦理审查的时间
医学伦理委员会审查(GCP和科研)会议计划每月召开(无项目顺延至下个月),时间定在每个月最后一个星期三上午10:00时。诊疗技术应用伦理委员会审查(新技术新项目)会议1年召开2次,需要时可以增加审查会议次数。伦理委员会办公室受理送审文件后,一般需要l周的时间进行处理,请在会议审查l周前提交送审文件。
研究过程中出现重大或严重问题,危及受试者安全时,或发生其它需要伦理委员会召开会议进行紧急审查和决定的情况,伦理委员会将召开紧急会议进行审查。
三、审查决定的传达
伦理委员会办公室在做出伦理审查决定后5个工作日内,以“伦理审查意见”的PDF版在线传达审查决定,并通知申请人到伦理办公室领取纸质版。
如果审查意见为肯定性决定(同意继续研究,或不需要采取进一步的措施),并且审查类别属于安全性审查,违背方案审查,暂停/终止研究审查,结题审查,以及上述审查类别审查后的复审,伦理委员会的决定可以不传达。申请人在伦理委员会受理送审材料后一个半月内没有收到伦理委员会的审查意见,视作伦理审查意见为 “同意”或“不需要采取进一步的措施”。
四、伦理审查的费用
药物/医疗器械临床试验项目合同应包括伦理审查费用。科研项目预算应包括伦理审查费。
药物/医疗器械临床试验项目的伦理初始审查费用陆仟元人民币,修正后重审费用陆仟元人民币;跟踪审查为快速审查的不收取费用;跟踪审查为会议审查的,按照每次会议贰仟元收取审查费用。
科研项目的伦理初始审查费用伍佰元人民币(包括初始审查、跟踪审查、复审)。伦理审查费归医院财务科统一管理。
为指导主要研究者/申办者、课题负责人提交临床研究的伦理审查申请/报告特制定本指南。
一、提交伦理审查的研究项目范围
根据国家药品监督管理局“药物临床试验质量管理规范”(2020年),“医疗器械临床试验质量管理规范”(2022年),“药物临床试验伦理审查工作指导原则”(2010年),卫生部“涉及人的生物医学研究伦理审查办法”(2016年),国务院“中华人民共和国人类遗传资源管理条例”(2019年),下列范围的研究项目应依据本指南提交伦理审查申请/报告:
·药物临床试验
·医疗器械临床试验
·科研项目
·生物样本库
二、伦理审查申请/报告的类别
1.初始审查
·初始审查申请:符合上述范围的研究项目,应在研究开始前提交伦理审查申请,经同意后方可实施。“初始审查申请”是指首次向伦理委员会提交的审查申请。
2.跟踪审查
·修正案审查申请:研究过程中若变更主要研究者,对临床研究方案、知情同意书、招募材料等的任何修改,应向伦理委员会提交修正案审查申请,经同意后执行。为避免研究对受试者的即刻危险,研究者可在伦理委员会同意前修改研究方案,事后应将修改研究方案的情况及原因,以“修正案审查申请”的方式及时提交伦理委员会审查。
·研究进展报告:应按照伦理审查批件/意见规定的年度/定期跟踪审查频率,在截止日期前1个月提交研究进展报告;申办者应当向组长单位伦理委员会提交各中心研究进展的汇总报告;如果伦理审查批件有效期到期。需要申请延长批件有效期,应通过“研究进展报告”申请。
·安全性报告
·除研究方案或者其他文件(如研究者手册)规定的不需要立即报告的严重不良事件外,研究者应当立即向申办者报告所有的严重不良事件,随后应当及时提供详尽、书面的随访报告。研究者应当按研究方案的要求和时限向申办者报告方案中规定的、对安全性评价重要的不良事件和实验室异常值。
·研究者应当向伦理委员会提交申办者提供的安全性报告,包括可疑且非预期严重不良反应(SUSAR)报告,其他潜在的严重安全性风险信息的报告,年度安全性报告。
·可疑且非预期严重不良反应(SUSAR):研究者应当向伦理委员会快速报告由申办方提供的可疑且非预期严重不良反应。快速报告的时限要求:致死或危及生命的应在首次获知后7天内报告。非致死或危及生命的应在首次获知后15天内报告。随访报告应在获得新信息起15天内。
·其他潜在的严重安全性风险信息的报告:申办者分析评估任何来源的安全性信息时发现:1.明显影响药品风险获益评估的信息或可能考虑药品用法改变,或影响总体药品研发进程的信息,应当尽快报告。例如,预期的严重不良反应的发生率增加,判断具有临床重要性;对暴露人群有明显的危害,如在治疗危及生命疾病时药品无效;在新进完成的动物实验中的重大安全性发现(如致癌性)。2.从其他来源获得的与试验药物相关的非预期严重不良反应及其他潜在严重安全性风险的信息,应当快速报告。
·年度安全性报告:这是申报者的研发期间安全性更新报告中的执行概要,并附严重不良反应累计汇总表,以及最新修订版的研究者手册副本。
·偏离方案报告:需要报告伦理委员会的偏离方案情况包括:
为消除受试者紧急危害的偏离方案,或者增加受试者风险或者显著影响试验实施的偏离方案,应当及时报告。其他的偏离方案,可以定期汇总向伦理委员会报告。
对于同一类型持续性的偏离方案,申办者和研究者应谨慎评估对受试者安全和研究科学性的影响,符合及时报告的标准,应及时报告。
·暂停/终止研究报告:研究者/申办者暂停或提前终止临床研究,应及时向伦理委员会提交暂停/终止研究报告。
·结题报告:完成临床研究,应及时向伦理委员会提交结题报告。
3.复审
·复审申请:上述初始审查和跟踪审查后,按伦理审查意见“作必要的修正后同意”,对方案进行修改后,应以“复审申请”的方式再次送审,经伦理委员会同意后可实施:如果对伦理审查意见有不同的看法,可以“复审申请”的方式申诉不同意见,请伦理委员会重新考虑决定。
4.简易审查(针对研究者申报科研项目前、个案报告、以发表论文为目的的回顾性研究)
·简易审查申请:符合上述范围的研究项目,研究者在申报国家或地方政府等科研项目前、个案报告、以发表论文为目的的回顾性研究,可按照伦理审查简易审查程序提交伦理审查申请。审查通过后出具伦理审查意见通知书。
三、变更或豁免知情同意
变更知情同意是指仍然会获得知情同意,但披露的要素或知情同意的文件证明与法规要求有所不同,包括:1.变更提供给受试者的信息,例如隐瞒信息。2.变更知情同意的文件证明,例如免除知情同意的签字。
豁免知情同意是指豁免知情同意的整个要求,包括同意过程的属性和披露要素,这意味着允许研究人员在没有获得完全知情同意的情况下进行研究。
变更或豁免知情同意应当同时满足以下三个前提条件:
·如果没有变更或豁免,研究将不可行或无法实施。
·研究具有重要的社会价值
·研究对受试者造成的风险不超过最低风险
所有涉及人的生物医学研究必须得到个人或其监护人的知情同意。变更或豁免知情同意需要正当的理由并得到伦理委员会的审查同意。
